„Die Impfung an sich funktioniert.“
Der „Booster“ gegen Krebs
Die Idee gab es schon lange vor der Pandemie. Und sie klang wie eine Zukunftsvision aus Star Trek: Mithilfe von Bio-Technologie soll der eigene Körper den Krebs bekämpfen. Dafür lässt man dem Immunsystem die nötigen Informationen zukommen. Eine modifizierte mRNA „benachrichtigt“ den Körper – „die Herstellung des eigentlichen Impfstoffes wird in den Menschen verlagert“, erklärt Dr. Niels Halama, Abteilungsleiter für Translationale Immuntherapie am Deutschen Krebsforschungszentrum (DKFZ) sowie Abteilungsleiter am Nationalen Centrum für Tumorerkrankungen (NCT) in Heidelberg.
mRNA (englisch für messenger ribonucleic acid, deutsch für Boten-Ribonukleinsäure) ist die Bezeichnung für eine einzelsträngige Kette, die genetische Informationen für den Aufbau eines Proteins überträgt. Sie kommt natürlicherweise in unseren Zellen vor. Dort verlässt sie als eine Kopie eines Stücks unserer DNS (englisch: DNA) den Zellkern und wird nach der Verwendung abgebaut.
Besonders Forscher*innen zweier Firmen haben in den letzten Jahrzehnten die Entwicklung der mRNA-Technologie vorangetrieben: CureVac und BioNTech. Und das abseits vom großen Rampenlicht von Medizin- und Wissenschaftskreisen. Die mRNA galt als schwer zu handhaben, weil der Körper sie kurz nach der Benutzung wieder auflöst. Außerhalb der beiden Firmen und deren Forscher*innen interessierte sich die Medizinwelt nicht sehr dafür.
Beweisführung in der Pandemie
Dann brach die Covid-19-Pandemie aus. Um einen Impfstoff gegen Covid-19 herzustellen, nutzte BioNTech die vorhandene mRNA-Technik. Das Mainzer Unternehmen brachte damit als erster Konzern einen tauglichen Impfstoff auf den Markt. Dafür passten sie die mRNA an das Virus an. Der Impfstoff ging in Serie und zeigte sich als ein geeignetes Mittel, um das Virus und damit die Pandemie zu bekämpfen.
Zurück auf die Krebsforschung gemünzt, ergeben sich dadurch erste Beweise: „Die Impfung an sich funktioniert“, sagt Halama, „und sie weist ein günstiges Nebenwirkungsprofil auf.“ Dazu bringt die Anwendung der mRNA-Technik in der Pandemie noch mehr positive Effekte mit sich. Zum einen eine plötzliche Bekanntheit, heute kann die breite Bevölkerung mit dem Begriff „mRNA“ etwas anfangen. Zusätzlich brachte sie auch für die Krebsforschung nutzbare Daten, zum Beispiel über die Verträglichkeit eines mRNA-Impfstoffes. Für eine vollkommen verlässliche Forschungsgrundlage wolle man laut Halama noch weitere Studien abwarten, unter anderem die Langzeit- und Beobachtungsstudie des Paul-Ehrlich-Instituts, deren Ergebnis erst im nächsten Jahr veröffentlicht werden soll.
Anwendung bei Covid-19 oder Krebs unterscheidet sich
Bei Krebs wirkt die mRNA-Impfung aber ein wenig anders als bei Covid-19. Die Impfung beugt Tumorerkrankungen nicht vor, sondern sie soll bei deren Behandlung eingesetzt werden. Außerdem nutzt der Covid-19-Impfstoff „die volle Stärke der neuen Technik noch gar nicht aus“, wie Halama erklärt. Diese Stärke liegt nämlich in der hohen spezifischen Anpassbarkeit. Im Labor kann die mRNA beliebig zusammengesetzt werden und wird damit passend auf die jeweilige Tumorzelle zugeschnitten.
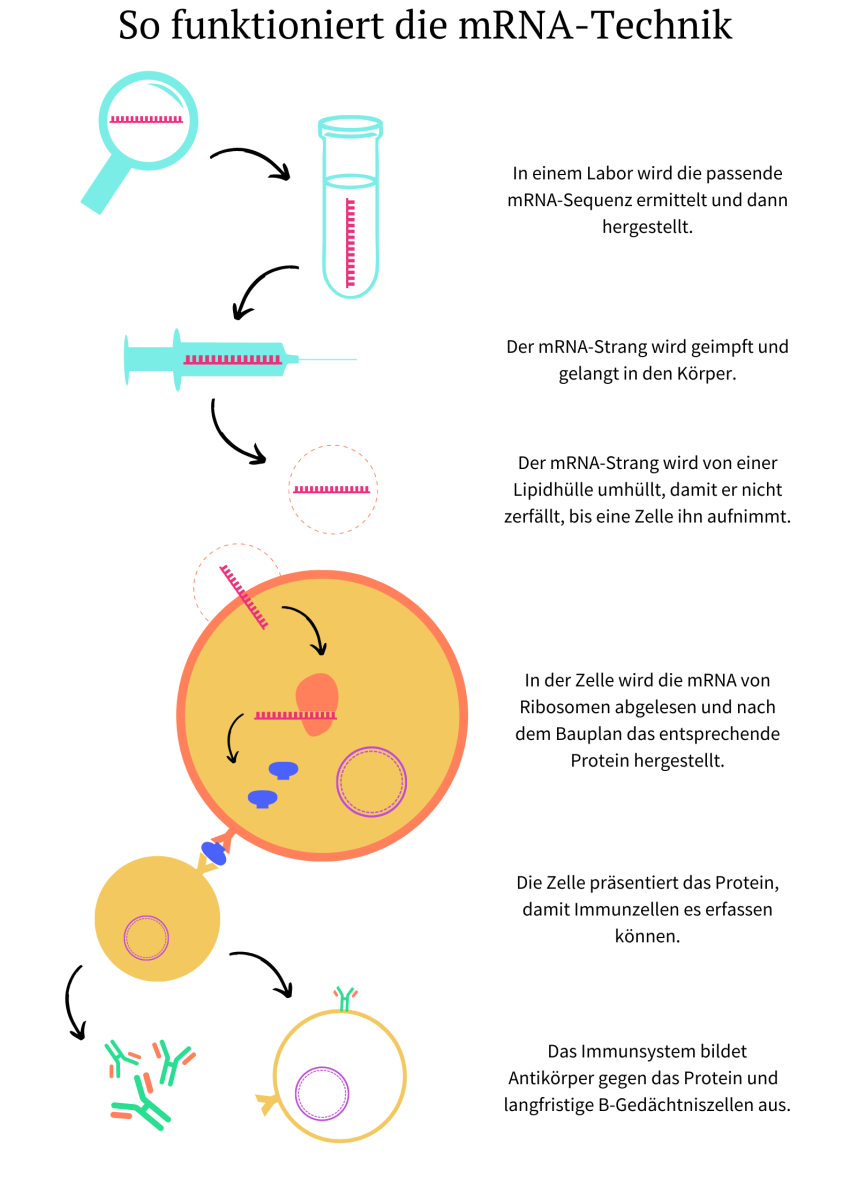
„Jeder Tumor hat Strukturen, die es bei normalen Körperzellen nicht gibt“, sagt Halama. Gegen diese Strukturen soll das Immunsystem wieder aktiviert werden, und zwar durch die mRNA-Impfung. Der entsprechende Bauplan dazu wird von den Körperzellen im Körper umgesetzt und das entsprechende Protein hergestellt. Dann wird es den Immunzellen präsentiert und die Immunantwort ausgelöst. Im Idealfall geht es dann den gewohnten Gang: Antikörper etwa können an den spezifischen Strukturen der Krebszellen „andocken“ und sie somit erkennbar machen, damit das Immunsystem diese zerstört.
„Jeder Tumor hat Strukturen, die es bei normalen Körperzellen nicht gibt.“
Was in der Theorie simpel klingt, gestaltet sich in der Praxis weitaus komplexer. Denn Krebserkrankungen entstehen dadurch, dass entartete Körperzellen den natürlichen Schutzmechanismus des Körpers umgehen. Die Krebszellen „tarnen“ sich vor dem Immunsystem. „Tumorzellen schützen sich auf sehr vielen Wegen“, erklärt Halama. Deshalb reiche eine mRNA-Impfung allein nicht aus. Es brauche kombinierte Therapieansätze.
Die Krebstherapie fußt auf mehreren Ansätzen, die meist ergänzend eingesetzt werden: Manche Tumorenbestandteile können mithilfe der Chirurgie operativ entfernt werden. Bei der Radiotherapie werden Krebszellen bestrahlt und dadurch zerstört. Dazu kommt die medikamentöse Therapie, wo die Chemotherapie oder auch die Immuntherapie ansetzt. In der Immuntherapie werden momentan sogenannte Checkpoint-Inhibitoren eingesetzt, Antikörper, die bestimmte Krebszellen für die Immunzellen markieren. Zukünftig könnten diese Checkpoint-Inhibitoren mit einer mRNA-Impfung kombiniert werden.
Grundsätzlich ist die mRNA-Technik „gegen jede Tumorerkrankung einsetzbar“, erklärt Halama. Voraussetzung sei, dass man Gewebeproben entnehmen kann, um diese nach den speziellen Strukturen des Tumors zu untersuchen. Diese unterscheiden sich von Tumor zu Tumor und daher auch von Patient*in zu Patient*in. Und da kommt die große Stärke der mRNA ins Spiel – sie kann für jede*n Patient*in spezifisch angepasst werden. Wenn der Aufbau des Bauplans bekannt ist, ist es möglich, im Labor die mRNA sehr schnell zusammenzusetzen. In wenigen Wochen kann der zugeschnittene Impfstoff hergestellt sein.
mRNA hat viele Vorteile
Dass die mRNA nach der Verwendung wieder schnell vom Körper abgebaut wird, ist ebenfalls nützlich. Die fortlaufende Therapie kann dadurch überwacht und gesteuert werden. „Da kann man ganz präzise nachjustieren“, so Halama. Dazu sind kombinierte Einsätze von mRNA möglich, weil sich bei den Tumorzellen möglicherweise mehrere Strukturen als Ansatzpunkt eigneten. Metastasen, vom Tumor getrennte Tochtergeschwülste, können so mitbehandelt werden. Meist weisen diese nämlich etwas andere Strukturen auf, für die es einen angepassten Bauplan braucht.
Durch diese spezifische Anpassung können zukünftige Therapien ganz anders in den Patient*innen wirken. Beispielsweise wäre denkbar, dass die mRNA-Technik die Chemotherapie ersetzen könnte. Denn die sollen gegen ausgewählte Tumorerkrankungen helfen und werden bei vielen Patient*innen gleich eingesetzt. Dabei wirken sie, ohne von Freund oder Feind zu unterscheiden. „Bei der Chemotherapie kommen Zellgifte zum Einsatz, die auch gesunde Zellen auflösen“, so Halama. Ein großer Nachteil, den die mRNA-Technik nicht hat. Ob Chemotherapien irgendwann der Vergangenheit angehören und durch mRNA-Impfungen ersetzt werden, muss sich jedoch erst noch zeigen.
Auch interessant
Studien laufen gerade
Aktuell finden viele Studien gleichzeitig statt. BioNTech beispielsweise testet zurzeit mehrere mRNA-Wirkstoffe. Auch Niels Halama forscht gemeinsam mit BioNTech am Helmholtz-Institut für Translationale Onkologie. „Die Studien laufen noch, wir warten da gerade auf Ergebnisse“, sagt der Onkologe. Dabei handelt es sich größtenteils um Phase-I- und Phase-II-Studien, das heißt, es wird die Verträglichkeit für Menschen getestet. Bis es da zu Ergebnissen kommt, dauere es allerdings noch ein paar Jahre.
Phase-I-Studien sind Studien im kleineren Rahmen, bei denen der Wirkstoff erstmalig beim Menschen angewendet wird. Grundlegende Dinge wie Sicherheit oder Verträglichkeit werden überprüft. Phase-II-Studien sind mit einigen hundert Teilnehmer*innen etwas größer und werden bei Patient*innen mit der Erkrankung angewendet, bei der der Wirkstoff wirken soll. Genauere Informationen gibt es beim Dossier des Bundesministeriums für Bildung und Forschung.
Bis die mRNA-Technik also richtigen Einsatz findet, dauert es noch. Einige Dinge sind auch noch ungeklärt, etwa welche Strukturen am Tumor sich überhaupt eignen. „Vieles ist da noch Zukunftsmusik“, mahnt Halama zur Geduld. Die vorläufigen Daten zur Wirksamkeit stimmten zwar optimistisch, bedürften aber noch weiterer Überprüfung und weiterer Studien.
Die mRNA-Technik wird kein Allheilmittel sein
Trotz der vielfältigen Möglichkeiten wird die mRNA-Technik kein Wunderheilmittel werden. Vieles sei auch abhängig von den Patient*innen und der jeweiligen Behandlung, erklärt Halama. Bei großer Tumorlast wirkt die Immuntherapie per mRNA anders als bei Patient*innen, die schon operiert wurden und bei denen dann kleine Reste des Tumors von den Immunzellen bekämpft werden. Und auch wenn grundsätzlich jeder Tumor per mRNA-Therapie behandelt werden könnte, wird nicht jedes Krebsleiden auf einen Schlag heilbar sein.
Die mRNA-Technik habe jedoch eine sehr vielversprechende Zukunft: „Die Möglichkeit, den Körper mithilfe der mRNA zu benachrichtigen und ihm präzise Anweisungen zu geben, hat sehr großes Potenzial“, erklärt Halama. Es stehe mit der mRNA ein Werkzeug zur Verfügung, das in sehr vielen Bereichen der Medizin Nutzen finden werde.